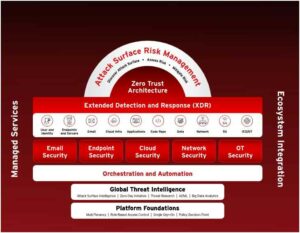
Az Európai Gyógyszerügynökség nyilatkozata a StemExR vizsgálatáról
3 perc olvasás![]() Olasz, magyar, spanyol, izraeli és egyesült államokbeli klinikai vizsgálóhelyeken hamarosan megkezdenek egy nemzetközi vizsgálatot a StemEx nevű, leukémia, nyirokcsomó-daganat (lymphoma) és myelodysplasiás syndroma (MDS) elleni kísérleti kezeléssel.
Olasz, magyar, spanyol, izraeli és egyesült államokbeli klinikai vizsgálóhelyeken hamarosan megkezdenek egy nemzetközi vizsgálatot a StemEx nevű, leukémia, nyirokcsomó-daganat (lymphoma) és myelodysplasiás syndroma (MDS) elleni kísérleti kezeléssel.
![]() Olasz, magyar, spanyol, izraeli és egyesült államokbeli klinikai vizsgálóhelyeken hamarosan megkezdenek egy nemzetközi vizsgálatot a StemEx nevű, leukémia, nyirokcsomó-daganat (lymphoma) és myelodysplasiás syndroma (MDS) elleni kísérleti kezeléssel.
Olasz, magyar, spanyol, izraeli és egyesült államokbeli klinikai vizsgálóhelyeken hamarosan megkezdenek egy nemzetközi vizsgálatot a StemEx nevű, leukémia, nyirokcsomó-daganat (lymphoma) és myelodysplasiás syndroma (MDS) elleni kísérleti kezeléssel.
A Gamida Cell-Teva Vegyes Vállalat (VV) 2010 január 18-án bejelentette, hogy az EMA Gyermekgyógyászati Bizottsága (PDCO) általános érvényű termékspecifikus lemondási nyilatkozatot adott ki a StemEx-re a gyermekgyógyászatilag érintett népesség (születéstől 17 éves korig) teljes vonatkozásában.
A PDCO hangsúlyozta, hogy a lemondó nyilatkozatok megadása nem akadályozza meg a VV-t, hogy a StemEx fejlesztését megfontolja az azt igénylő gyermekekre vonatkozólag. A StemEx-et a Gamida Cell és a Teva Pharmaceuticals (NASDAQ: TEVA) egyenlő arányú tulajdonában lévő vegyes vállalat fejleszti.
Az Európai Unióban egy új gyógyászati termék törzskönyvezéséhez a gyártónak általában nemcsak felnőttek, hanem gyermekek esetén is klinikailag bizonyítania kell a termék hatékonyságát és biztonságosságát.
Ezen felül, a vállalatnak a PDCO-hoz be kell nyújtania egy Gyermekgyógyászati Vizsgálati Tervet (PIP) mind a négy alkorcsoportra, melyek lefedik a születéstől a 17 éves korig terjedő életkort. A VV benyújtott egy 12-17 éves korra vonatkozó PIP-et és egy termékspecifikus lemondási nyilatkozat iránti kérelmet a születéstől a 11 éves korig terjedő három korcsoportra.
Mivel a StemEx előnye elsősorban az idősebb gyermekek és felnőtt betegek esetén valósul meg, a PDCO engedélye összhangban van a VV stratégiájával, miszerint a StemEx-et eleinte kamaszkorú és felnőtt betegek részére fejlesztik.
Michal Austin, törzskönyvezési igazgató kifejtette, hogy "Jól ismert, hogy a köldökzsinórvérben lévő őssejtek korlátozott száma kamaszok és felnőttek esetén akadályozza a köldökzsinórvér beültetés gyógyászati alkalmazását. A Gamida Cell módszere annyira felszaporítja a köldökzsinórvér őssejtek ezen csekély számát alacsony differenciálódás mellett, hogy nagyobb gyermekek és felnőttek terápiás kezelésére alkalmas lehessen.
Tehát a VV célja a StemEx-szel, hogy jelentősen szélesítse az alapellátás körét, amely gyermekeknél már általános gyakorlattá vált. Végül is hiszünk abban, és ezzel az Ügynökség is egyetért, hogy a StemEx előtérbe helyezett fejlesztésével a legnagyobb klinikai hiánnyal bíró, azaz a serdülők és felnőtt betegek kezelésére fogunk megoldást kínálni. Ez azt jelenti, hogy 2011-re elérhetjük a piacra kerülést."
A Gamida Cell most toborozza a betegeket a StemEx-szel mint serdülőkorú (nagyobb gyermekek) és felnőtt leukémiás betegeknek szánt kísérleti célú kezeléssel végzett klinikai vizsgálatba olasz, magyar, spanyol, izraeli és egyesült államokbeli vezető köldökzsinórvér-transzplantációs klinikai vizsgálóhelyeken.